描述:
RNAtrip成功避开各种商业RNA提取试剂盒的种种弊端,采用最新技术和工艺,在提取过程中既能有效裂解组织细胞,强烈抑制RNA酶活性,保护RNA免受降解,同时也能极为有效地分离去除DNA和蛋白质。RNAtrip使RNA分离如同提取质粒DNA一样简单可靠,可在30-60分钟内完成,获得极高纯度的总RNA沉淀,可用于RT-PCR、Northern Blot、RNA酶保护、Poly(A) mRNA纯化、体外翻译等实验。
储存:
4oC密封避光保存两年以上有效。因疏忽或冰箱意外停电,RNAtrip密封避光存放于25oC室温数个月,品质不受影响。
适用:
(1) 固体组织 (100mg/ml ): 人、动物、植物的各种新鲜或冻存组织。
(2) 培养细胞 (5~10×106细胞/ml): 真核细胞,细菌、酵母。
(3) 液体标本(100μl/ml): 全血、体液、尿液,病毒样品等。
用户实验用品和操作准备:
极微量的RNA酶都会导致RNA降解。分离RNA时,RNA酶污染主要来自以下五个方面:(1)来自实验人员的双手。(2)来自器皿、吸头离心管、自备液体。(3)组织细胞破碎不可避免地释放内源RNA酶。(4)RNA未能完全与蛋白质分离。(5)RNA沉淀和溶解时来自吸头离心管和溶液。我们的Step by Step质量监测表明,RNAtrip可100%抑制RNA酶活性并在分离步骤完全清除RNA酶。因此在有RNAtrip存在的步骤中,使用高压消毒20分钟的吸头离心管和溶液即可胜任RNA提取操作。然而在RNA溶解之后,来自实验材料的RNA酶污染将会导致RNA降解,应严格使用高压灭活RNA酶的用品。戴手套无疑是有益的,但戴口罩和帽子则无必要。只要严格按照本指南进行准备和操作,使用RNAtrip总是能获得高纯度RNA。
1.固体组织破碎设备。准备下列装置之一,1)玻璃匀浆器。必要时泡酸清洁,用高压灭菌蒸馏水洗涤数次。2)研钵。适用于液氮冻存组织的研磨,清洗方法同玻璃匀浆器。3)组织细胞超声破碎仪器。探头插入装满蒸馏水的试管或烧杯中,开启超声清洗探头30秒至1分钟。4)高速机械匀(Polytron,Tekmar或类似产品)。打开开关,在蒸馏水中清洗分散器头数次。对这些装置的部分部件高压消毒30分钟是保险的措施,但使用RNAtrip这种处理并不必要。
2.高压蒸汽30分钟消毒一次性吸头离心管。RNA沉淀和溶解之后,应严格使用高压消毒的一次性用品。然而RNAtrip能在RNA酶污染环境下工作,在裂解步骤可使用未高压但洁净的一次性吸头和离心管,但仅推荐在紧急情况下这样做。比如由于不可预测的原因,动物已经处死,组织已取出,细胞已收取,而吸头和离心管尚未高压处理。这仅仅适用于RNAtrip试剂,对其它来源RNA提取试剂无效。此时保险做法是使用普利莱基因技术公司的另一种产品――组织RNA保护液(Cat# R1030),用户可把来不及处理的标本保存在RNA保护液中,37oC保存3天,25oC保存2周,4oC保存4周,-20oC保存数月,固体或液体标本中RNA不会降解。
3. DEPC处理的双蒸水。加DEPC到水中至终浓度为0.01%v/v,室温过夜,高压消毒30分钟。用于溶解RNA,配制TE缓冲液和75%乙醇。
4. 普通双蒸水,高压消毒30分钟,用于冲洗器皿,配制琼脂糖凝胶和电泳用缓冲液。注意溶液配制后高压灭菌,但琼脂糖不能高压处理。
5. 异丙醇,氯仿,纯乙醇,分析纯。75%乙醇用高压消毒蒸馏水配制。
6. 其他用品:电泳槽,双蒸水冲洗。离心机和加样器,无需处理。
7. 冰盒和湿冰。在冰上进行操作有助于减少RNA降解。
8. 戴手套。注意某些实验如提取质粒DNA使用大量RNA酶,为防污染须特别清洗实验器具和实验区域。
RNA 提取程序
1. 组织细胞破碎与裂解
冰上操作。立即并快速破碎组织至关重要。组织细胞过量不仅使RNA得率下降,还将导致DNA和蛋白质污染。在紧急情况下,如动物已处死,组织已取出,细胞已收取,异地取送标本,用户尚未做好实验准备时,推荐用户把组织细胞储存在RNA保护液(Cat# R1020)中,保证标本中的RNA不被降解。
(1) 固体组织。按比例每50-100mg组织加1ml RNAtrip试剂。用研钵研磨(仅适用于液氮冻存组织):组织放在研钵中研成粉末,加1 ml RNAtrip试剂,继续研磨至组织完全裂解。用玻璃匀浆器匀浆:加入RNAtrip上下手动匀浆组织10-15次。用高速机械匀浆器:将组织放入塑料试管内,试管置冰浴烧杯中,加入RNAtrip试剂,将分散器头垂直插入管内与组织块接触,转速12,000-20,000 rpm,上下移动试管10-20次,直到组织完全打散,无肉眼可见大块。用超声仪:需根据机器型号进行预试验,选取有效破碎组织的功率和时间。
注意:
(1)通常用50-100mg组织可获得足量的RNA,对绝大多数实验目的绰绰有余。加入过量组织或过少RNAtrip容易导致提取失败。(2)少量难以打碎的组织碎片不影响后续RNA提取。(3)用研钵和玻璃匀浆器匀浆破碎组织时,应略微多加一些裂解液,以补充裂解产物粘在容器壁上造成的体积丢失。
(2)培养细胞。贴壁细胞:弃培养基,用PBS缓冲液冲洗细胞一次。每5-10′106个细胞加1ml RNAtrip试剂,但RNAtrip加入量必须有效地覆盖瓶皿的细胞表面。一个75cm2瓶皿的细胞通常需要2ml提取液,一个35cm2瓶皿的细胞需要 1ml提取液,更小的培养瓶皿可使用更少的提取液,但后续操作会因体积过小而极为不便。晃动或用吸头吹打使提取液流过并裂解所有细胞。置冰上5分钟,倾斜瓶皿使粘稠的裂解物聚于一处以便取出。悬浮细胞:低速离心收集细胞,将细胞快速重悬于50-100ml的PBS或去离子水中,每5-10′106细胞加1ml RNAtrip裂解。注意直接裂解未重悬的细胞沉淀,裂解物将十分粘稠而难以分散。细菌酵母:离心收集沉淀,加入50-100ml去离子水重悬细胞。每107细胞加入1-2 ml RNAtrip直接裂解。某些细菌和酵母细胞可能需要匀浆破碎。
(3) 液体标本:如体液、尿液、全血。每100ml液体样品加1ml RNAtrip,置冰上1-3分钟。未抗凝的凝固血液按固体组织处理。RNAtrip Liq (Cat# R1020)产品专门用于液体标本RNA提取。
2. 将组织细胞裂解物转移到1.5ml离心管,置冰上10分钟。优化步骤:如果组织裂解物含较多的碎片,或提取植物组织,12,000g 4oC 离心10 分钟,取上层裂解液,弃管底碎片和粘稠DNA。如果提取脂肪组织,12,000g 4oC 离心10分钟,小心吸掉最上面的油层,弃去。再取裂解液,弃管底碎片和粘稠DNA。取出的裂解液如带少量油滴不影响提取。
3. 加入0.2体积的氯仿(0.2ml),充分颠倒混匀,冰浴5分钟,溶液分相。有时分相不明显,不影响提取。
4. 12,000 ′g 4oC离心10分钟,溶液分为两相。RNA在上层水相,下层为有机相,两相界面是一层薄膜其厚度与组织细胞类型和多少有关。小心吸出0.5ml上层水相转移到新离心管。注意:取上清液时应保留0.5-1 mm厚的水相,以免扰动和吸入下面的碎片和有机相。如果吸入,应将所取的上清液放回管中并重新离心10分钟,再次吸取水相。这一点至关重要,违背此原则容易导致RNA降解和DNA污染。如需同时提取DNA或蛋白质,则保留中间相和下层有机相,向公司索要操作方法。
5. 加入等体积异丙醇(0.5ml)于上清液充分混匀。冰上孵育10分钟沉淀RNA。用更低的温度和更长的时间进行沉淀并不必要。如果起始组织细胞的量很少,-20oC放置一至数小时可沉淀几乎所有的RNA。
注意:从富含多糖的植物组织或富含糖原的动物肝脏组织提取RNA时,按以下步骤进行:以每1 ml RNAtrip裂解组织,加氯仿后离心得到约0.5ml上清液计算,分别加入上清液一半体积即0.25ml 的高盐溶液(0.8 M 柠檬酸钠和1.2M NaCl)和0.25ml异丙醇,混匀。执行下面的离心沉淀步骤6。离心后可有效沉淀RNA,但多糖或糖原存留在上清可被弃去。从富含多糖的植物和动物肝脏组织提取RNA时,推荐使用植物RNA分离试剂Plant RNAtrip或Plant RNA Extraction Kit。
6. 12,000 ′g,4oC 离心10分钟。管底可见少许RNA沉淀。注意:如初始组织细胞量少,RNA将附着在管壁,用肉眼几乎难辨沉淀,但不影响实验。如RNA 沉淀量很多并呈胶冻状,通常表明有蛋白污染。应仔细检查操作步骤。
7. 弃上清。立即加入1 ml 用DEPC水配制的75%乙醇,颠倒混匀数次洗涤沉淀。12,000 ′g离心5分钟。弃上清,尽量完全吸去管壁上的液体。注意:乙醇洗涤后RNA沉淀容易漂浮,勿倒掉或吸走RNA沉淀。RNA沉淀在75%乙醇中可在4oC保存一周或在-20oC保存一年。
8. 敞开管口空气干燥5-10分钟使残留液体挥发,略微干燥RNA沉淀即可。用50-100 ml自备的DEPC处理的高压消毒纯水或TE溶解沉淀。RNA溶液可保存于-70oC或液氮中。注意:过分干燥将使RNA难以溶解。55oC加热或反复冻融数次可以助溶。RNA溶液加3倍体积乙醇冻存于-2oC,用时离心淀。
效果展示:
左图:
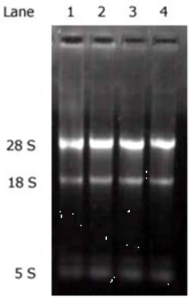
RNAtrip试剂提取大鼠几种组织和小鼠原代心肌细胞总RNA1%常规琼脂糖凝胶。Lane 1, 大鼠骨骼肌;Lane2,肝脏;Lane3,心脏;Lane4,小鼠原代心肌细胞。用RNAtrip提取的28S与18S RNA的亮度比例在接近3:1,明显超出通常的2:1,而凝胶前沿5SRNA处几乎没有降解RNA;同时加样孔和泳道未见高亮度的基因组DNA的污染残留,表明RNAtrip提取的RNA纯度和完整性高、没有降解
右图:
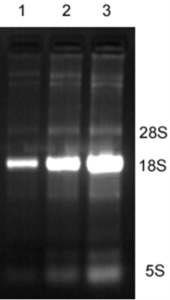
RNAtrip试剂提取棉铃虫胸部组织总RNALane 1-3上样量递增。棉铃虫18S RNA的含量大于28S RNA。RNAtrip提取的高纯度棉铃虫胸部组织总RNA,18S RNA最亮,5SRNA处几无降解RNA,加样孔无高亮度的基因组DNA污染残留。
说明:
1. 每100mg组织RNA预期得率为:肝脾60-100mg, 肾50mg, 脑组织10-15mg, 胎盘20-40mg, 脂肪50mg。1x107个细胞通常得50-100 mg。1. 测定OD值,根据OD260计算RNA浓度。OD260/280比值可初步判断RNA质量,比值在1.6-2.0之间均属正常。起始组织量过大,或吸取了有机相或碎片,将使RNA样品中蛋白和杂质含量高,RNA沉淀乙醇洗涤不充分(步骤7),均可导致OD260/280比值降低。但切记OD260/280比值还受很多非质量因素的影响。例如,RNA用水溶解或pH偏酸OD260/280偏低,用TE或离子强度较高的溶液溶解时较高,但均不影响RNA后续使用。切记即便是已降解的RNA,OD260/280比值也能达到看似完美的2.0左右,因此该比值并非判断RNA降解与否最佳的指标。判断RNA质量的最佳途径是进行普通RNA琼脂糖电泳检查RNA完整性。
2. 检查RNA完整性。取1mg RNA样品进行1%普通琼脂糖凝胶电泳。溴化乙锭染色,紫外灯观察。28S RNA~5kb亮度应该约为18S RNA~2kb的两倍,有时可见0.1-0.3kb 的5SRNA。
3. 调整RNA溶液的体积或重沉淀RNA。(1)加入适量DEPC处理过的高压消毒纯水或TE缓冲液,于RNA溶液中,使溶液体积补齐到约400ml;(2)加入0.1体积的3M 醋酸钠pH 5.2,混匀;(3)加入2.5体积的纯乙醇,混匀;(4)冰上孵育10分钟;(5)执行上述RNA提取程序的步骤6-8。
4. RNAtrip勿直接接触皮肤和吸入。如接触皮肤,立即用大量水清洗。